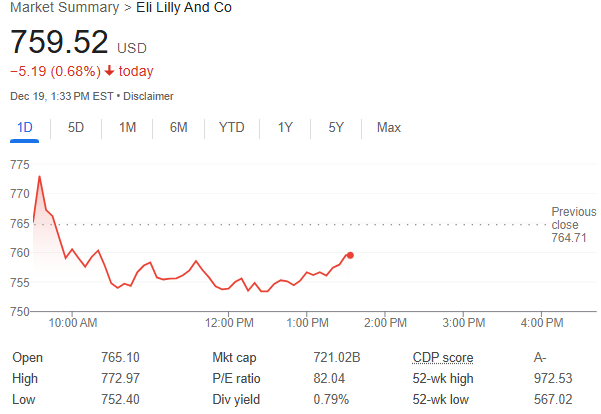
来源:华尔街见闻
美国FDA宣布,礼来公司减肥药Zepbound的活性成分司美格鲁肽(tirzepatide)不再短缺,复合药房将不再被允许生产未经批准的仿制药。FDA要求这些配药房在60到90天内停止生产仿制版本,过渡期旨在让患者切换至品牌药物。消息公布后,礼来和诺和诺德股价跌幅均收窄。
美东时间12月20日周四,美国食品和药物管理局(FDA)宣布,制药巨头礼来公司减肥药Zepbound的活性成分司美格鲁肽(tirzepatide)不再短缺。
此举意味着,FDA将不再允许复合药房生产未经批准的、无品牌、更便宜的tirzepatide仿制药版本。现在,FDA要求这些复合药房在接下来的60到90天内停止生产仿制版tirzepatide,具体期限取决于配药设施的类型。此过渡期旨在为患者提供足够的时间切换至品牌药。
FDA在一封信中表示:
“经过全面分析,FDA认定自2022年12月开始的tirzepatide注射剂短缺状况已经解决。FDA将继续监测这些产品的供需情况。”
这一决定无疑对许多复合药房造成了打击。许多复合药房声称,他们生产的仿制药版本能帮助那些没有保险覆盖Zepbound,或无力负担每月约1000美元高价药费的患者。特别是Zepbound以及其他减肥药通常不在许多保险计划的覆盖范围内,给患者带来了额外负担。
这是FDA与配药房之间围绕tirzepatide短缺问题的最新争议。作为Zepbound和礼来的糖尿病治疗药物Mounjaro的活性成分,tirzepatide的需求激增导致供不应求。为应对这一短缺情况,礼来已投资数十亿美元扩大tirzepatide的生产能力。然而,尽管礼来努力增加产能,仍然难以满足市场需求。
周四美股盘中,礼来一度跌超1.6%,诺和诺德一度跌超3%,此消息公布后,两家公司跌幅均收窄。
复合药房与FDA陷入法律纠纷
FDA与复合药房之间的矛盾已愈加公开化。今年10月8日,代表复合药房的行业组织——外包设施协会(Outsourcing Facilities Association)向法院提起诉讼,指控FDA在未充分通知的情况下,突然将tirzepatide从短缺清单中移除。该组织指控FDA未经适当通知就采取行动,无视tirzepatide仍然短缺的证据,并且可能偏袒礼来公司,损害患者利益。
在诉讼压力下,FDA表示将重新评估这一决定,并在审查期间允许复合药房继续生产仿制药。仿制药是为满足特定患者需求而定制的品牌药物替代品。过去两年里,Wegovy和Ozempic中的活性成分semaglutide一直处于间歇性短缺状态。根据联邦法律,当品牌药物短缺时,复合药房可以在满足某些要求的情况下制备该药物的仿制品。
在美国,Zepbound和其他减肥药通常不在许多保险计划的覆盖范围内,这使得仿制药物成为更经济实惠的选择。由于tirzepatide等品牌药物供应不稳定且价格昂贵(保险和其他折扣前每月高达1000美元),许多患者转向了仿制药物。
然而,复合药房的生产并不经过FDA的安全和有效性审查,因此FDA一直敦促患者使用官方批准的品牌药物。但FDA确实会对一些从事药物复合的外包设施进行检查。
在当今医药市场中,专利保护和市场供应紧密相连。以Wegovy、Ozempic、Zepbound和Mounjaro为例,这些药物在美国及海外均受到专利保护。药物制造商诺和诺德和礼来并不向外部团体供应这些药物的活性成分,这一策略不仅保护了其市场份额,也引发了对某些制造商向消费者销售和推广产品的非法仿制质疑。
然而,随着非法仿制药的增多,礼来和其他药物制造商采取了法律手段。过去一年中,这两家公司在美国境内对多个减肥诊所、医疗水疗中心以及复合药房提起诉讼。非法仿制药不仅侵犯了专利权,还有可能威胁消费者健康。FDA上个月也表示,已经收到患者因剂量错误而过量服用配制的司美格鲁肽的报告。
风险提示及免责条款
市场有风险,投资需谨慎。本文不构成个人投资建议,也未考虑到个别用户特殊的投资目标、财务状况或需要。用户应考虑本文中的任何意见、观点或结论是否符合其特定状况。据此投资,责任自负。













发表评论